Mol là gì? Khối lượng Mol là gì? Cách tính khối lượng Mol và thể tích Mol
Mol là gì? Khối lượng Mol là gì? Cách tính khối lượng Mol và thể tích Mol học sinh đã được tìm hiểu trong chương trình Hóa học 8. Nhằm giúp các bạn hệ thống lại tất cả các kiến thức cần ghi nhớ về mảng kiến thức Hóa học rất quan trọng này, Trường TCSP Mẫu giáo – Nhà trẻ Hà Nội đã chia sẻ bài viết sau đây. Các bạn theo dõi nhé !
I. MOL LÀ GÌ ?
1. Khái niệm:
Mol là lượng chất có chứa 6.1023 nguyên tử hoặc phân tử của chất đó.
Con số 6.1023 được gọi là số Avogaddro và kí hiệu số Avogadrolà N.
Mol được sử dụng chủ yếu trong lĩnh vực hóa học như một cách để thể hiện dễ dàng các phản ứng và các sản phẩm hình thành từ các phản ứng hóa học.
Ngoài ra, mol cũng được thể hiện cho số ion, nguyên tử hoặc các thực thể khác trong mẫu nhất định của một chất. Nồng độ dung dịch vũng được biểu thị bằng số mol của nó, ký hiệu là mol/lít, Nhìn vào ký hiệu có thể thấy, nồng độ dung dịch chính là lượng chất hòa tan trên một đơn vị thể tích.
2. Lịch sử phát triển của Mol
Lịch sử đơn vị mol liên quan chặt chẽ với các khái niệm phân tử khối, đơn vị khối lượng nguyên tử, hằng số Avogadro và các khái niệm có liên quan khác.
Tên gọi “mol” bắt nguồn từ tiếng Đức, do nhà hóa học Wilhelm Ostwald đặt ra vào năm 1894 dựa theo từ molekül của tiếng Đức (nghĩa là “phân tử”).
3. Phân loại Mol
Nguyên tử, phân tử là những hạt có kích thước vi mô. Chúng có kích thước nhỏ hơn hạt cát hàng nghìn, hàng vạn lần mà mắt ta không nhìn thấy được. Vì vậy mà các đơn vị đo lường dành cho các hạt vĩ mô không thể áp dụng lên chúng được. Các nhà khoa học đã đề xuất ra một đơn vị đo lường mới dành cho các hạt vi mô này, đó là mol. Vậy mol có 2 loại:
- Mol nguyên tử
- Mol phân tử

II. KHỐI LƯỢNG MOL LÀ GÌ ?
Khối lượng mol ( kí hiệu là M) của một chất là khối lượng tính bằng gam của N nguyên tử hoặc phân tử chất đó.
Đơn vị: g/mol
Khối lượng mol có cùng số trị với nguyên tử khối hay phân tử khối của chất đó.
Lưu ý, khối lượng mol của phân tử không giống khối lượng mol của nguyên tử. Ví dụ, khối lượng mol phân tử (hydro) là 2g trong khi khối lượng mol của nguyên tử H (hydro) chỉ là 1g.
III. CÁCH TÍNH KHỐI LƯỢNG MOL
1. Cách tính khối lượng Mol của một nguyên tử
Để tính khối lượng mol của một nguyên tố, ta lấy khối lượng nguyên tử của chất đó nhân với hệ số chuyển đổi gam trên mol (g/mol)
Công thức tính khối lượng mol nguyên tử:
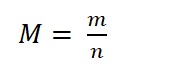
Trong đó:
- M là khối lượng mol, đơn vị (g/mol)
- m là khối lượng của chất đó, đơn vị (g)
- n là số mol chất, đơn vị (mol)
2. Cách tính khối lượng mol của hợp chất, phân tử
Khối lượng mol của một phân tử, hợp chất bao gồm nguyên tử của nhiều nguyên tố khác nhau bằng tổng khối lượng mol số nguyên tử có trong phân tử chất đó.
Xét trường hợp tổng quát với một hợp chất bất kì nào đó được cấu tạo bởi 3 nguyên tố hóa học có công thức hóa học là AaBbCc trong đó:
– A, B, C là nguyên tố hóa học tạo nên hợp chất.
– a, b, c là số nguyên tử tương ứng với mỗi nguyên tố.
Vậy khối lượng mol của hợp chất trên được tính bằng công thức sau
Mhc = MA x a + MB x b + MC x c
Ví dụ: Tính khối lượng mol của hợp chất sau đây
– Khối lượng mol của phân tử nước có công thức hóa học H2O là MH2O = MH2 + MO = (1 x 2 + 16) = 18 g/mol.
– Khối lượng mol của axit clohidric là MHCl = 1 + 35,5 = 36,5 g/mol
Lưu ý:
– Thường gặp nhiều khối lượng mol trong các bài tập tính toán
– Quy đổi khối lượng ra mol để tính toán cho tiện
IV. CÁCH TÍNH THỂ TÍCH MOL CỦA CHẤT KHÍ
1. Thể tích Mol của chất khí là gì?
Thể tích mol của chất khí là thể tích chiếm bởi N phân tử chất khí đó.
Trong đktc (0°C và 1 atm) thì thể tích 1 mol chất khí là 22,4 lít.
2. Cách tính thể tích Mol của chất khí
Trong điều kiện tiêu chuẩn, các tính mol sẽ tính theo công thức sau:

Trong đó:
- n chính là số mol
- V là thể tích khí ở điều kiện tiêu chuẩn
- 22,4 là hằng số trong điều kiện tiêu chuẩn.
Lưu ý: Trong trường hợp chất khí ở trạng thái tự nhiên, không phải là điều kiện tiêu chuẩn thì công thức trên không thể áp dụng. Chúng ta sẽ cần tới những công thức và phép tính phức tạp hơn.
V. BÀI TẬP VỀ MOL
Câu 1: Số Avogadro và kí hiệu là
A. 6.1023, A
B. 6.10-23, A
C. 6.1023 , N
D. 6.10-24, N
Câu 2: Tính số nguyên tử của 1,8 mol Fe
A. 10,85.1023 nguyên tử
B. 10,8.1023 nguyên tử
C. 11.1023 nguyên tử
D. 1,8.1023 nguyên tử
Câu 3: Khối lượng mol chất là
A. Là khối lượng ban đầu của chất đó
B. Là khối lượng sau khi tham gia phản ứng hóa học
C. Bằng 6.1023
D. Là khối lượng tính bằng gam của N nguyên tử hoặc phân tử chất đó
Câu 4:Cho biết 1 mol chất khí ở điều kiện bình thường có thể tích là
A. 2,24 l B. 0,224 l C. 22,4 l D. 22,4 ml
Câu 5: Tính thể tích ở đktc của 2,25 mol O2
A. 22,4 l B. 24 l C. 5,04 l D. 50,4 l
Câu 6: Số mol của H2 ở đktc biết V= 5,6 l
A. 0,25 mol B. 0,3 mol C. 0,224 mol D. 0,52 l
Câu 7: Thể tích mol là
A. Là thể tích của chất lỏng
B. Thể tích của 1 nguyên tử nào đó
C. Thể tích chiếm bởi N phân tử của chất khí đó
D. Thể tích ở đktc là 22,4 l
Câu 8: Số mol của kali biết có 6.1023 nguyên tử kali
A. 1 mol B. 1,5 mol C. 0,5 mol D. 0,25 mol
Câu 9: Chọn đáp án sai:
A. Khối lượng của N phân tử CO2 là 18 g
B. mH2O = 18 g/mol
C. 1 mol O2 ở đktc là 24 l
D. Thể tích mol của chất khí phải cùng nhiệt độ và áp suất
Câu 10: 1 mol N2 có V = 22,4 l. Hỏi 8 mol N2 thì cố V = ?. Biết khí đo ở đktc
A. 179,2 l B. 17,92 C. 0,1792 l D. 1,792 l
Đáp án:
| 1.A | 2.B | 3.D | 4.C | 5.D |
| 6.A | 7.C | 8.A | 9.C | 10.A |
Câu 2: 1 mol có 6.1023 thì 1,8 mol có 6.1023.1,8=10,8.1023 nguyên tử
Câu 5: 1 mol đktc là 22,4 l ⇒ 2,25 mol là 2,25.22,4 = 50,4 (l)
Câu 6: Lấy = 0,25 mol
Câu 8: số mol = 
⇔ số mol kali là 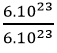 = 1 mol
= 1 mol
Câu 10: V = n.22,4 = 8.22,4 = 179,2 (l)
Với chuyên đề: Mol trên đây chúng ta có thể hiểu rõ về khái niệm, tính chất, khối lượng mol, cách tính thể tích mol.
Vậy là các bạn vừa được chia sẻ Mol là gì? Khối lượng Mol là gì? Cách tính khối lượng Mol và thể tích Mol của chất khí. Hi vọng, sau khi chia sẻ cùng bài viết, bạn nắm vững hơn mảng kiến thức Hóa học 8 rất quan trọng này. Bảng tuần hoàn các nguyên tố hóa học cũng đã được chúng tôi giới thiệu rất cụ thể. Bạn xem thêm nhé !