Dòng điện trong chất điện phân là dòng ion dương và ion âm chuyển động có hướng theo hai chiều ngược nhau. Ion dương chạy về phí catôt nên gọi là cation, Ion âm chạy về phía anôt nên gọi là anion.
Trong bài viết này chúng ta cùng tìm hiểu Thuyết điện li là gì? Bản chất của dòng điện trong chất điện phân, hiện tượng dương cực tan và định luật Fa-ra-đây. Ứng dụng quan trọng của dòng điện trong chất điện phân đối với công nghiệp luyện Nhôm.
I. Thuyết điện li
• Trong dung dịch, các hợp chất hóa học như axit, bazo và muối bị phân li (một phần hoặc toàn bộ) thành các nguyên tử (hoặc nhóm nguyên tử) tích điện gọi là ion; ion có thể chuyển động tự do trong dung dịch và trở thành hạt tải điện.
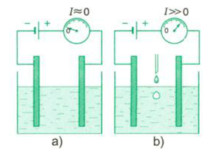 Khi trong cốc là nước tinh khiết, dòng điện rất nhỏ (hình a), cho thêm axit vào nước dòng điện tăng lên (hình b).
Khi trong cốc là nước tinh khiết, dòng điện rất nhỏ (hình a), cho thêm axit vào nước dòng điện tăng lên (hình b).
• Sự phân li của một số hợp chất:
– Axit → gốc axit (ion âm) + H+ .
– Bazo → OH– (ion âm) + ion dương (kim loại).
– Muối → gốc axit (ion âm) + ion dương (kim loại).
* Chú ý: Một số bazo không chứa ion kim loại nhưng cũng bị phân li thành ion trong dung dịch.
• Bản chất của sự phân li:
– Các ion âm và ion dương đã tồn tại sẵn các phân tử axit, bazo, muối. Chúng liên kết chặt với nhau bằng lực hút Cu–lông. Khi tan vào nước hoặc một dung môi khác, lực hút Cu–lông yếu đi, liên kết trở nên lỏng lẻo. Một số phân tử bị chuyển động nhiệt tách thành các ion tự do.
– Một số bazo hoặc muối không tan khi bị nóng chảy cũng phân li ra các ion.
– Những dung dịch và chất nóng chảy trên được gọi chung là chất điện phân.
II. Bản chất dòng điện trong chất điện phân
– Dòng điện trong lòng chất điện phân là dòng ion dương và ion âm chuyển động có hướng theo hai chiều ngược nhau.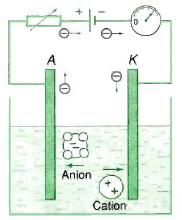 – Ion dương chuyển động về phía catot nên gọi là cation. Ion âm chuyển dịch về phía anot nên gọi là anion.
– Ion dương chuyển động về phía catot nên gọi là cation. Ion âm chuyển dịch về phía anot nên gọi là anion.
– Mật độ các ion trong dung dịch nhỏ hơn mật độ electron tự do trong kim loại nên dung dịch dẫn điện không tốt bằng kim loại.
– Dòng điện trong chất điện phân vừa dẫn điện lượng vừa tải vật chất. Khi đến các điện cực, vật chất bị giữ lại chỉ có electron có thể đi tiếp gây ra hiện tượng điện phân.
III. Các hiện tượng diễn ra ở điện cực. Hiện tượng dương cực tan
– Do dòng điện trong chất điện phân vừa tải điện lượng vừa tải vật chất nên khi xảy ra hiện tượng điện phân thì các cation dịch chuyển và bám vào catot, các anion dịch chuyển về phía anot và kéo các cation vào dung dịch gây nên hiện tượng dương cực tan.
– Hiện tượng dương cực tan: Là hiện tượng xảy ra kim loại dùng làm cực dương của bình điện phân (anot) trùng với kim loại của muối dùng làm dung dịch điện phân.
IV. Các định luật Fa-ra-day
• Khối lượng chất đi đến điện cực:
– Tỉ lệ thuận với điện lượng chạy qua bình điện phân;
– Tỉ lệ thuận vơi khối lượng của ion (hay khối lượng mol nguyên tử A của nguyên tố tạo nên ion ấy);
– Tỉ lệ nghịch với điện tích của ion (hay hóa trị n của nguyên tố tạo ra ion ấy);
• Định luật Fa-ra-day thứ nhất:
– Khối lượng vật chất được giải phóng ở điện cực của bình điện phân tỉ lệ thuận với điện lượng chạy qua bình đó:
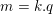
Với k là đương lượng điện hóa của chất được giải phóng ở điện cực.
• Định luật Fa-ra-day thứ 2:
– Đương lượng điện hóa k của một nguyên tố tỉ lệ với đương lượng gam 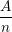 của nguyên tố đó. Hệ số tỉ lệ là
của nguyên tố đó. Hệ số tỉ lệ là 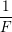 , trong đó F gọi là số Fa-ra-day.
, trong đó F gọi là số Fa-ra-day.
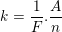
Trong đó: F = 96500 C/mol
A: khối lượng phân tử
n: hóa trị
• Kết hợp 2 định luật Fa-ra-đây, ta được công thức Fa-ra-đây:
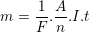
Trong đó: m là khối lượng chất được giải phóng (g)
F = 96500 C/mol
A: khối lượng phân tử
n: hóa trị
I: cường độ dòng điện
t: thời gian dòng điện chạy qua
V. Ứng dụng của hiện tượng điện phân
– Hiện tượng điện phân có nhiều ứng dụng trong thực tế sản xuất và đời sống như luyện nhôm, tinh luyện đồng, điều chế clo, xút, mạ điện, đúc điện,…
1. Luyện Nhôm
– Dựa vào hiện tượng điện phân quặng nhôm nóng chảy.
– Bể điện phân có cực dương là quặng nhôm nóng chảy, cực âm bằng than, chất điện phân là muối nhôm nóng chảy, dòng điện chạy qua khoảng 104(A).
2. Mạ điện
– Bể điện phân có anôt là một tấm kim loại để mạ, catôt là vật cần mạ.
– Chất điện phân thường là dung dịch muối kim loại để mạ. Dòng điện qua bể mạ được chọn một cách thích hợp để đảm bảo chất lượng của lớp mạ.
VI. Bài tập về Dòng điện trong chất điện li
* Bài 1 trang 85 SGK Vật Lý 11: Nội dung của thuyết điện li là gì? Anion thường là phần nào của phân tử?
° Lời giải bài 1 trang 85 SGK Vật Lý 11:
– Trong dung dịch, các hợp chất hóa học như axit, bazo và muối phân li (một phần hoặc toàn bộ) thành các nguyên tử và nhóm nguyên tử tích điện gọi là ion: ion có thể chuyển động tự do trong dung dịch và trở thành hạt tải điện.
– Anion thường là phần ion âm của phần tử thường là gốc axit hoặc nhóm (OH).
– Cation mang điện dương là ion kim loại ion H+ hoặc một số nhóm nguyên tử khác.
* Bài 2 trang 85 SGK Vật Lý 11: Dòng điện trong chất điện phân khác dòng điện trong kim loại như thế nào?
° Lời giải bài 2 trang 85 SGK Vật Lý 11:
– Dòng diện trong các chất điện phân là dòng chuyển dời có hướng của các ion dương và ion âm. Dòng điện trong các chất điện phân không chỉ tải điện lượng mà còn tải vật chất đi theo.
– Còn dòng điện trong kim loại là dòng chuyển dời có hướng của các electron tự do.
– Dòng điện trong chất điện phân yếu hơn trong kim loại và dòng điện trong chất điện phân không chỉ tải điện lượng mà còn tải cả vật chất.
* Bài 3 trang 85 SGK Vật Lý 11: Hãy nói rõ hạt tải điện mạng điện trên các phần khác nhau của mạch điện có chứa bình điện phân:
a) Dây dẫn và điện cực kim loại.
b) Ở sát bề mặt của hai điện cực.
c) Ở trong lòng chất điện phân.
° Lời giải bài 3 trang 85 SGK Vật Lý 11:
¤ Hạt tải điện mang dòng điện trên các phần tử của mạch điện có chứa bình điện phân:
a) Trong phần dây dẫn và các điện cực kim loại: hạt tải điện là các electron tự do.
b) ở sát bề mặt hai điện cực.
– Sát cực dương: các ion âm (anion)
– Sát cực âm: các ion dương (cation)
c) Ở trong lòng chất điện phân: dòng chuyển dời có hướng của các ion dương cùng chiều điện trường và ion âm ngược chiều điện trường.
* Bài 4 trang 85 SGK Vật Lý 11: Chất điện phân thường dẫn điện tốt hơn hay kém hơn kim loại? Tại sao?
° Lời giải bài 4 trang 85 SGK Vật Lý 11:
¤ Chất điện phân thường dẫn diện yếu hơn kim loại. Nguyên nhân:
– mật độ các ion trong điện phân nhỏ hơn mật độ cac electron tự do trong kim loại.
– khối lượng và kích thước của các ion trong chất điện phân lớn hơn khối lượng các electron, nên tốc độ chuyển động có hướng của chúng nhỏ hơn electron.
– Môi trường dung dịch điện phân mất trật tự hơn, nên cản trở mạnh chuyển động có hướng của các ion.
– Môi trường dung dịch điện phân mất trật tự hơn, nên cản trở mạnh chuyển động có hướng của các ion.
* Bài 5 trang 85 SGK Vật Lý 11: Hai bể điện phân: bể A để luyện nhôm, bể B để mạ niken. Hỏi bể nào có cực dương tan? Bể nào có suất phản điện?
° Lời giải bài 5 trang 85 SGK Vật Lý 11:
– Bể A để luyện nhôm có cực dương bằng than (graphit) nên không có hiện tượng cực dương tan.
– Bể B để mạ niken có cực dương là niken và chất điện phân NiSO4 nên sẽ có hiện tượng dương cực tan.
– Bể nào không có cực dương tan thì sẽ đóng vai trò là máy thu điện và khi đó có suất phản điện, như vậy bể A để luyện nhôm có suất phản điện.
* Bài 6 trang 85 SGK Vật Lý 11: Phát biểu định luật Fa-ra- đây, công thức Fa-ra-đây và đơn vị dùng trong công thức này.
° Lời giải bài 6 trang 85 SGK Vật Lý 11:
• Định luật Fa-ra-đây thứ 1
– Khối lượng của vật chất được giải phóng ở điện cực của bình điện phân tỉ lệ thuận với điện lượng chạy qua bình đó.
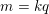
Trong đó: k là đương lượng điện hóa của chất được giải phóng ở điện cực.
• Định luật Fa-ra-đây thứ 2
– Đương lượng điện hóa k của một nguyên tố tỉ lệ với đương lượng gam A/n của nguyên tố đó. Hệ số tỉ lệ là 1/F trong đó F là số Fa-ra-đây:
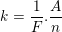
Trong đó: F = 96500 C/mol
A: khối lượng phân tử
n: hóa trị
• Kết hợp 2 định luật Fa-ra-đây, ta được công thức Fa-ra-đây:
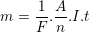
Trong đó: m là khối lượng chất được giải phóng (g)
F = 96500 C/mol
A: khối lượng phân tử
n: hóa trị
I: cường độ dòng điện
t: thời gian dòng điện chạy qua
* Bài 7 trang 85 SGK Vật Lý 11: Khi điện phân dung dịch H2 SO4 với điện cực bằng graphit, ta thu được khí oxi bay ra. Có thể dùng công thức Fa-ra-đây để tính khối lương oxi bay ra được không?
° Lời giải bài 7 trang 85 SGK Vật Lý 11:
– Được, ta co thể dùng công thức Fa-ra-day để tính lượng khí bay ra. Vì định luật Fa-ra-đây có thể áp dụng với cả các chất được giải phóng ở điện cực nhờ phản ứng phụ.
– Công thức Fa-ra-đây để tính khối lượng oxi bay ra như sau:
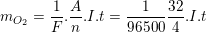
* Bài 8 trang 85 SGK Vật Lý 11: Phát biển nào chính xác? Dòng điện trong chất điện phân là chuyển động có hướng của:
A. các chất tan trong dung dịch
B. các icon dương trong dung dịch
C. các icon dương và các icon âm dưới tác đụng của điện trường trong dung dịch
D. các icon dương và icon âm theo chiều điện trường trong dung dịch.
° Lời giải bài 8 trang 85 SGK Vật Lý 11:
¤ Chọn đáp án: C.các icon dương và các icon âm dưới tác đụng của điện trường trong dung dịch
– Dòng điện trong chất điện phân là dòng chuyển dời có hướng của các icon dương và các icon âm dưới tác dụng của điện trường trong dung dịch.
* Bài 9 trang 85 SGK Vật Lý 11: Phát biển nào chính xác? Kết quả cuối cùng của quá trình điện phân dung dịch CuSO4 với điện cực bằng đồng là:
A. không có thay đổi gì ở bình điện phân.
B. anot bị ăn mòn.
C. đồng bám vào catot.
D. đồng chạy từ anot sang catot.
° Lời giải bài 9 trang 85 SGK Vật Lý 11:
¤ Chọn đáp án: D. đồng chạy từ anot sang catot.
– Kết quả cuối cùng của quá trình điện phân dung dịch CuSO4 với điện cực bằng đồng là đồng chạy từ anôt sang catôt.
* Bài 10 trang 85 SGK Vật Lý 11: ion Na+ và Cl– trong nước có thể tính theo công thức: v=μE trong đó E là cường độ điện trường, μ là độ linh động có giá trị lần lượt là 4,5.10-8 m2/(V.s). Tính điện trở suất của dung dịch NaCl nồng độ 0,1 mol/l, cho rằng toàn bộ các phần tử NaCl đều phân li thành icon.
° Lời giải bài 10 trang 85 SGK Vật Lý 11:
– Điện trở của khối vật dẫn được tính theo công thức:
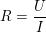 hoặc
hoặc 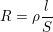
nên suy ra: 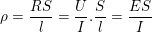
Trong đó, cường độ điện trường: 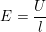
– Cường độ dòng điện I đo bằng tổng điện lượng chạy qua diện tích S của dây dẫn trong 1 giây.
– Tốc độ chuyển động có hướng của các ion trong nước có thể tính theo công thức: v = μ.E
– Nếu gọi vNa và vCl là tốc độ có hướng của ion Na+ và Cl– ; n là mật độ các ion này thì ta có:
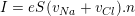
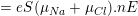
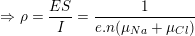
– Theo bài ra, nồng độ của NaCl là:
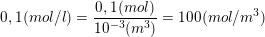
nên số hạt tải điện của Na+ và Cl– là:
nNa+ = nCl– = 100.6,023.1023 = 6,023.1025 (hạt/m3).
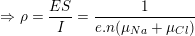
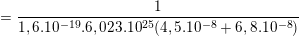
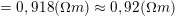
* Bài 11 trang 85 SGK Vật Lý 11: Người ta muốn bọc một lớp đồng dày d = 10 μm trên một bản đồng điện tích S=1cm2 bằng phương pháp điện phân. Cường độ dòng điện là 0,010A. Tính thời gian cần thiết để bọc được lớp đồng. Cho biết đồng có khối lượng riêng là ρ = 8900 kg/m3.
° Lời giải bài 11 trang 85 SGK Vật Lý 11:
¤ Đề cho: d = 10μm = 10.10-6 (m); S = 1cm2 = 10-4(m2); ρ = 8900 kg/m3;
– Khối lượng đồng cần bọc khỏi bản đồng là:
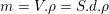
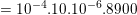
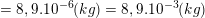
– Mặt khác, theo định luật Fa-ra-đây khối lượng đồng cần bóc khỏi bản đồng trong thời gian t là:
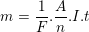
– Thời gian cần thiết để bọc được lớp đồng là:
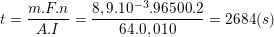
– Kết luận: t = 2684(s) = 44,73(phút).
Hy vọng với bài viết về Dòng điện trong chất điện phân, Thuyết Điện li, Định luật FA-RA-ĐÂY và Ứng dụng ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại dưới phần bình luận để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tập tốt.