Hoá 11 bài 16: Tính chất hoá học của cacbon oxit (CO), cacbon dioxit (CO2) muối cabonnat và bài tập vận dụng. Các bon oxit (CO), các bon dioxit (CO2) muối các bon nát là các hợp chất quan trọng của các bon mà các em cần nắm vững.
Vậy Các bon oxit (CO), cac bon dioxit (CO2) muối các bon nát có những tính chất hoá học nào quan trọng, làm sao để điều chế và ứng dụng được các oxit cacbon và muối cacbonat, chúng ta hãy cùng tìm hiểu qua bài viết này.
I. Cacbon oxit (các bon oxit) – CO
1. Cấu tạo phân tử và tính chất vật lý của cacbon oxit – CO
– Cấu tạo của CO là C≡O (trong đó có 1 liên kết thuộc kiểu cho – nhận).
– CO là chất khí, không màu, không mùi, không vị, tan rất ít trong nước và rất bền với nhiệt.
– CO là khí độc vì nó kết hợp với hemoglobin ở trong máu tạo thành hợp chất bền làm cho hemoglobin mất tác dụng vận chuyển khí O2.
2. Tính chất hoá học của cacbon oxit – CO
– Phân tử CO có liên kết ba bền vững nên ở nhiệt độ thường C rất trơ, chỉ hoạt động trong điều kiện nhiệt độ cao.
– CO là oxit trung tính không có khả năng tạo muối → không tác dụng với dung dịch bazơ và dung dịch axit ở nhiệt độ thường.
* Cacbon oxit là chất khử mạnh.
a) CO tác dụng với các phi kim:
2CO + O2 ![small xrightarrow[]{700^{0}C}](https://thpt-phamhongthai.edu.vn/wp-content/uploads/2022/11/1605058182rtdw56xxxz.gif) 2CO2
2CO2
CO + Cl2 → COCl2 (photgen)
b) CO khử oxit của các kim loại
– CO khử oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại (phản ứng xảy ra ở nhiệt độ cao).
3CO + Fe2O3 ![small xrightarrow[]{t^{0}} 1605058182vro4w5r2p4 1605058182vro4w5r2p4](https://thpt-phamhongthai.edu.vn/wp-content/uploads/2022/11/1605058182vro4w5r2p4.gif) 3CO2↑ + 2Fe↓
3CO2↑ + 2Fe↓
CO + CuO ![small xrightarrow[]{t^{0}} 1605058182vro4w5r2p4 1605058182vro4w5r2p4](https://thpt-phamhongthai.edu.vn/wp-content/uploads/2022/11/1605058182vro4w5r2p4.gif) CO2↑ + Cu↓
CO2↑ + Cu↓
3. Điều chế cacbon oxit
– Trong công nghiệp:
C + H2O 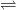 CO + H2 (10500C)
CO + H2 (10500C)
CO2 + C ![small xrightarrow[]{t^{0}} 1605058182vro4w5r2p4 1605058182vro4w5r2p4](https://thpt-phamhongthai.edu.vn/wp-content/uploads/2022/11/1605058182vro4w5r2p4.gif) 2CO
2CO
– Trong phòng thí nghiệm:
HCOOH ![small xrightarrow[]{t^{0},xt}](https://thpt-phamhongthai.edu.vn/wp-content/uploads/2022/11/1605058183njuqux2hhu.gif) CO + H2O (H2SO4 đặc, t0)
CO + H2O (H2SO4 đặc, t0)
4. Nhận biết cacbon oxit
5CO + I2O5 → 5CO2 + I2

II. Cacbon đioxit (các bon dioxit) – CO2
1. Cấu tạo phân tử và tính chất vật lí của cacbon đioxit
– Cấu tạo của CO2 là O=C=O.
– Là khí không màu, vị hơi chua. Tan ít trong nước. CO2 khi bị làm lạnh đột ngột là thành phần chính của nước đá khô. Nước đá khô không nóng chảy mà thăng hoa nên được dùng để làm môi trường lạnh và khô, rất tiện lợi để bảo quản thực phẩm.
2. Tính chất hóa học của cacbon đioxit CO2
a) CO2 là oxit axit
– CO2 tan trong nước tạo thành axit cacbonic (là một điaxit rất yếu):
CO2 + H2O 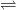 H2CO3
H2CO3
– CO2 tác dụng với oxit bazơ → muối:
CaO + CO2 ![small xrightarrow[]{t^{0}} 1605058182vro4w5r2p4 1605058182vro4w5r2p4](https://thpt-phamhongthai.edu.vn/wp-content/uploads/2022/11/1605058182vro4w5r2p4.gif) CaCO3
CaCO3
– CO2 tác dụng với dung dịch bazơ → muối + (H2O)
NaOH + CO2 → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
* Phản ứng của CO2 với dung dịch kiềm tạo thành muối nào tuỳ thuộc vào tỉ lệ số mol của 2 chất tham gia phản ứng.
b) CO2 bền, ở nhiệt độ cao bị nhiệt phân một phần và tác dụng được với các chất khử mạnh
2CO2 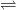 2CO + O2 (t0)
2CO + O2 (t0)
CO2 + 2Mg → 2MgO + C
CO2 + C → 2CO
c) CO2 còn được dùng để sản xuất ure
CO2 + 2NH3 → NH4O – CO – NH2 (amoni cacbamat)
NH4O – CO – NH2 ![small small xrightarrow[]{180^{0}C;200at} 1548842350yuwgu6hu4n 1605058185 1548842350yuwgu6hu4n 1605058185](https://thpt-phamhongthai.edu.vn/wp-content/uploads/2022/11/1548842350yuwgu6hu4n_1605058185.gif) H2O + (NH2)2CO
H2O + (NH2)2CO
3. Điều chế cacbon dioxit
– Quá trình hô hấp của người và động vật:
C6H12O6 + 6O2 → 6CO2 + 6H2O
– Quá trình lên men bia rượu:
C6H12O6 → 2CO2 + 2C2H5OH
– Quá trình đốt cháy nhiên liệu:
CxHy + (x + y/4)O2 → xCO2 + y/2H2O
– Trong công nghiệp, đốt cháy hoàn toàn than cốc trong không khí hoặc nhiệt phân đá vôi:
C + O2 → CO2
CaCO3 ![small xrightarrow[]{1000^{0}C} 1605058185nwaj7hwjfg 1605058185nwaj7hwjfg](https://thpt-phamhongthai.edu.vn/wp-content/uploads/2022/11/1605058185nwaj7hwjfg.gif) CaO + CO2
CaO + CO2
– Trong phòng thí nghiệm:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
4. Nhận biết cacbon dioxit
– Tạo kết tủa trắng với dung dịch nước vôi trong dư.
CO2 + Ca(OH)2 → CaCO3 + H2O
III. Muối cacbonat (cac bon nát)
– Là muối của axit cacbonic (gồm muối CO32- và HCO3–).
1. Tính tan
– Các muối cacbonat trung hoà của kim loại kiềm (trừ Li2CO3), amoniac và các muối hidrocacbonat dễ tan trong nước (trừ NaHCO3 ít tan). Các muối cacbonat trung hoà của những kim loại khác không tan hoặc ít tan trong nước.
2. Tính chất hóa học của muối cacbonat
* Sự thủy phân:
+ Muối cacbonat của kim loại kiềm bị thủy phân mạnh tạo môi trường kiềm:
Na2CO3 → 2Na+ + CO32-
CO32- + H2O 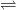 HCO3– + OH‑
HCO3– + OH‑
– Trong một số phản ứng trao đổi Na2CO3 đóng vai trò như 1 bazơ:
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 6NaCl + 3CO2
– Muối (NH4)2CO3 có môi trường trung tính.
* Sự nhiệt phân:
+ Muối cacbonat tan không bị nhiệt phân (trừ muối amoni), muối cacbonat không tan bị nhiệt phân:
MgCO3 ![small xrightarrow[]{t^{0}} 1605058182vro4w5r2p4 1605058182vro4w5r2p4](https://thpt-phamhongthai.edu.vn/wp-content/uploads/2022/11/1605058182vro4w5r2p4.gif) MgO + CO2
MgO + CO2
+ Tất cả các muối hiđrocacbonat đều bị nhiệt phân:
2NaHCO3 ![small xrightarrow[]{t^{0}} 1605058182vro4w5r2p4 1605058182vro4w5r2p4](https://thpt-phamhongthai.edu.vn/wp-content/uploads/2022/11/1605058182vro4w5r2p4.gif) Na2CO3 + CO2 + H2O
Na2CO3 + CO2 + H2O
Ca(HCO3)2 ![small xrightarrow[]{t^{0}} 1605058182vro4w5r2p4 1605058182vro4w5r2p4](https://thpt-phamhongthai.edu.vn/wp-content/uploads/2022/11/1605058182vro4w5r2p4.gif) CaCO3 + H2O + CO2
CaCO3 + H2O + CO2
* Tính chất hóa học chung của muối:
+ Tác dụng với axit → muối mới + CO2 + H2O
NaHCO3 + HCl → NaCl + H2O + CO2
– Lưu ý: Nếu cho H+ vào muối tan thì CO32- → HCO3- → H2O + CO2.
Nếu cho H+ vào muối không tan thì CO32- → CO2 + H2O.
+ Tác dụng với dung dịch bazơ → muối mới + bazơ mới
NaHCO3 + NaOH → Na2CO3 + H2O
+ Tác dụng với muối → 2 muối mới
Na2CO3 + CaCl2 → CaCO3 + 2NaCl
+ Tác dụng với kim loại đứng trước kim loại tạo muối → muối mới + kim loại mới
Cu(HCO3)2 + Mg → Mg(HCO3)2 + Cu
3. Nhận biết muối cacbonat
– Cho tác dụng với axit → CO2
CaCO3 + 2HCl ® CaCl2 + CO2 + H2O
IV. Bài tập về các-bon-oxit CO, các-bon-dioxit CO2 và muối các-bon-nát
Bài 4 trang 75 SGK Hóa 11: a) Khi đun nóng dung dịch canxi hidrocacbonat thì có kết tủa xuất hiện. Tổng các hệ số tỉ lượng trong phương trình hóa học của phản ứng là: A. 4 ; B. 5 ; C. 6 ; D. 7
b) Khi cho dư khí CO2 vào dung dịch chứa kết tủa canxi cacbonat, thì kết tủa sẽ tan. Tổng các hệ số tỉ lượng trong phương trình hóa học của phản ứng là: A. 4 ; B. 5 ; C. 6 ; D. 7
* Lời giải bài 4 trang 75 SGK Hóa 11:
– Viết PTHH xảy ra, sau đó cân bằng và cộng tổng tất cả các hệ số của các chất trong phương trình lại.
a. Đáp án A
Ca(HCO3)2 ![small xrightarrow[]{t^{0}} 1605058182vro4w5r2p4 1605058182vro4w5r2p4](https://thpt-phamhongthai.edu.vn/wp-content/uploads/2022/11/1605058182vro4w5r2p4.gif) CaCO3 + CO2 + H2O
CaCO3 + CO2 + H2O
⇒ Tổng hệ số = 1 + 1 + 1 + 1 = 4
b. Đáp án A
CaCO3 + CO2 + H2O → Ca(HCO3)2
⇒ Tổng hệ số = 1 + 1 + 1 + 1 = 4
Bài 5 trang 75 SGK Hóa 11: Cho 224,0 ml CO2 (đktc) hấp thụ hết trong 100,0ml dung dịch kali hidroxit 0,200 M. Tính khối lượng của những chất có trong dung dịch tạo thành.
* Lời giải bài 5 trang 75 SGK Hóa 11:
– Theo bài ra, ta có: nCO2 = 0,224/22,4 = 0,01 (mol);
nKOH = V.CM = 0,1.0,2 = 0,02 (mol).
⇒ Ta có tỉ lệ: 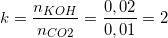
* Lưu ý:
- Nếu k ≤1 ⇒ chỉ tạo muối KHCO3
- Nếu 1 < k ⇒ tạo cả 2 muối KHCO3 và K2CO3
- Nếu k ≥ 2 ⇒ chỉ tạo muối K2CO3
⇒ Phương trình tạo muối trung hoà
CO2 + 2KOH → K2CO3
⇒ Trong dụng dịch sau sau phản ứng chỉ có K2CO3
mK2CO3 = 0,01.138 = 1,38 (g).
Bài 6 trang 75 SGK Hóa 11: Nung 52,65 g CaCO3 ở 100oC và cho toàn bộ lượng khí thoát ra hấp thụ hết vào 500,0 ml dung dịch NaOH 1,800M. Hỏi thu được những muối nào? Khối lượng là bao nhiêu? Biết rằng hiệu suất phản ứng nhiệt phân CaCO3 là 95%.
* Lời giải bài 6 trang 75 SGK Hóa 11:
– Theo bài ra, ta có: nCaCO3 = m/M = 52,65/100 = 0,5265 (mol).
nNaOH = V.CM = 0,5.1,8 = 0,9 (mol).
– Phương trình hoá học của phản ứng:
CaCO3 ![small xrightarrow[]{t^{0}}](https://thpt-phamhongthai.edu.vn/wp-content/uploads/2022/11/1605058187b9x7ji5two.gif) CaO + CO2
CaO + CO2
– Từ phương trình suy ra: nCO2 = nCaCO3 = 0,5265 (mol)
Do hiệu suất phản ứng là 95% nên: nCO2 thực tế = 95%.0,5265 = 0,5 (mol)
– Tỉ lệ mol: 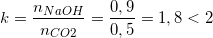
⇒ Tạo ra hỗn hợp 2 muối là Na2CO3 và NaHCO3
CO2 + NaOH → NaHCO3
x x (mol) x (mol)
CO2 + 2NaOH → Na2CO3 + H2O
y 2y (mol) y (mol)
– Theo bài và phương trình phản ứng ta có:
∑nCO2 = x + y = 0,5 (mol).
∑nNaOH = x + 2y = 0,9 (mol).
– Giải hệ trên, ta được: x = 0,1 và y = 0,4
⇒ mNaHCO3 = 0,1.84 = 8,4 (g).
⇒ mNa2CO3 = 0,4.106 = 42,4 (g).
Hi vọng với phần hệ thống lại kiến thức về tính chất hoá học của các bon oxit, các bon dioxit và muối các bon nát ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để Trường TCSP Mẫu giáo – Nhà trẻ Hà Nội ghi nhận và hỗ trợ, chúc các em học tập tốt.
Bản quyền bài viết thuộc trường Trường THPT Phạm Hồng Thái. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường THPT Phạm Hồng Thái (thpt-phamhongthai.edu.vn)





