Hóa 10 bài 14: Tinh thể nguyên tử là gì? tinh thể phân tử là gì? cho ví dụ và bài tập về tinh thể nguyên tử. Tại sao nước lỏng thì linh động và nặng, còn nước đá thì cứng và nhẹ hơn nước lỏng. Điều này là do trong tinh thể phân tử nước đá các phân tử nước sắp xếp theo một trật tự nhất định và ở cách xa nhau hơn trong nước lỏng.
Bài này chúng ta sẽ tìm hiểu về tinh thể nguyên tử là gì? tinh thể phân tử là gì? cấu tạo và tính chất của tinh thể nguyên tử và tinh thể phân tử ra sao?
I. Tinh thể nguyên tử
1. Tinh thể nguyên tử là gì?
– Tinh thể nguyên tử cấu tạo từ những nguyên tử được sắp xếp một cách đều đặn, theo một trật tự nhất định trong không gian tạo thành mạng tinh thể.
– Ở các nút của mạng tinh thể là những nguyên tử liên kết với nhau bằng các liên kết cộng hóa trị.
* Ví dụ: Tinh thể kim cương: Mỗi nguyên tử cacbon liên kết với 4 nguyên tử cacbon khác bằng 4 liên kết cộng hóa trị.
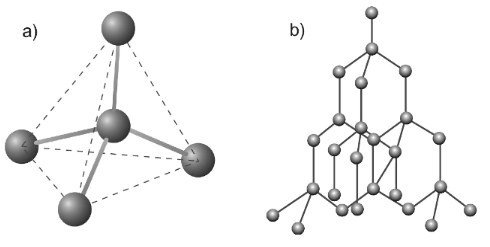 Mô hình cấu trúc tinh thể kim cương
Mô hình cấu trúc tinh thể kim cương
a) Sự sắp xếp tứ diện của bốn nguyên tử C xung quanh nguyên tử C trung tâm ở kim cương
b) Tinh thể kim cương
2. Tính chất chung của tinh thể nguyên tử
– Lực liên kết cộng hóa trị trong tinh thể nguyên tử rất lớn, vì vậy, tinh thể bền vững, rất cứng, nhiệt độ nóng chảy và nhiệt độ sôi khá cao.
– Kim cương có độ cứng lớn nhất so với các tinh thể đã biết nên được quy ước có độ cứng là 10 đơn vị để đo độ cứng các chất khác.
II. Tinh thể phân tử
1. Tinh thể phân tử là gì?
– Tinh thể phân tử cấu tạo từ những phân tử được sắp xếp một cách đều đặn theo trật tự nhất định trong không gian tạo thành mạng tinh thể phân tử.
– Ở các điểm nút của mạng tinh thể là những phân tử liên kết với nhau bằng lực tương tác yếu giữa các phân tử.
– Phần lớn các chất hữu cơ, các đơn chất phi kim ở nhiệt độ thấp đều kết tinh thành mạng tinh thể phân tử (phân tử có thể gồm một nguyên tử như các khí hiếm, hoặc nhiều nguyên tử như: halogen, O2, N2, H2, H2O, H2S, CO2,…)
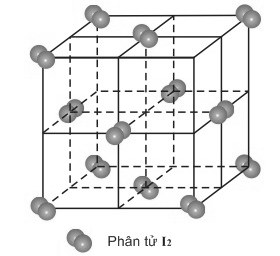
* Ví dụ: Tinh thể phân tử I2
2. Tính chất tinh thể phân tử
– Lực tương tác giữa các phân tử rất yếu nên các chất có cấu tạo tinh thể phân tử thường mềm, có nhiệt độ nóng chảy thấp, dễ bay hơi.
– Các tinh thể không phân cực, dễ dàng hòa tan trong các dung môi không phân cực như: Benzen. toluen,…
III. Bài tập về tinh thể nguyên tử, tinh thể phân tử
* Bài 1 trang 70 SGK Hóa 10: Tìm câu sai trong các câu sau:
A. Kim cương là một dạng thù hình của cacbon, thuộc loại tinh thể nguyên tử.
B. Trong mạng tinh thể nguyên tử, các nguyên tử được phân bố luân phiên đều đặn theo một trật tự nhất định.
C. Lực liên kết giữa các nguyên tử trong tinh thể nguyên tử là liên kết yếu.
D. Tinh thể nguyên tử bền vững, rất cứng, nhiệt độ nóng chảy và nhiệt độ sôi cao.
* Lời giải:
– Câu sai: C. Lực liên kết giữa các nguyên tử trong tinh thể nguyên tử là liên kết yếu.
Lực liên kết cộng hóa trị trong tinh thể nguyên tử rất lớn.
* Bài 2 trang 70 SGK Hóa 10: Tìm câu sai trong các câu sau đây:
A. Nước đá thuộc loại tinh thể phân tử.
B. Trong tinh thể phân tử, lực liên kết yếu giữa các phân tử là liên kết cộng hóa trị.
C. Trong tinh thể phân tử, lực liên kết giữa các phân tử là liên kết yếu.
D. Tinh thể iot là tinh thể phân tử.
* Lời giải:
– Câu sai: B. Trong tinh thể phân tử, lực liên kết yếu giữa các phân tử là liên kết cộng hóa trị.
Trong tinh thể phân tử, các phân tử hút nhau bằng lực tương tác yếu giữa các phân tử.
* Bài 3 trang 71 SGK Hóa 10: Hãy kể tên các loại tinh thể đã học và tính chất chung của từng loại.
* Lời giải:
Các loại tinh thể đã học:
– Tinh thể nguyên tử: tính chất chung: bền vững, rất cứng, nhiệt độ nóng chảy và nhiệt độ sôi khá cao.
– Tinh thể phân tử: tính chất chung: dễ nóng chảy, dễ bay hơi.
– Tinh thể ion: tính chất chung: rất bền vững, các hợp chất ion đề khá rắn, khó bay hơi, khó nóng chảy.
* Bài 4 trang 71 SGK Hóa 10: a) Hãy đưa ra một số thí dụ chất có mạng tinh thể nguyên tử, chất có mạng tinh thể phân tử.
b) So sánh nhiệt độ nóng chảy của hai loại tinh thể nói trên. Giải thích?
* Lời giải:
a) – Chất có mạng tinh thể nguyên tử: kim cương.
– Chất có mạng tinh thể phân tử: ở nhiệt độ thấp thì có khí hiếm, O2, N2,… kết tinh thành tinh thể phân tử.
b) Lực liên kết cộng hóa trị trong tinh thể nguyên tử rất lớn. Vì vậy, tinh thể nguyên tử đều bền vững, khá cứng, khó nóng chảy, khó bay hơi. Trong tinh thể phân tử, các phân tử hút nhau bằng lực tương tác yếu giữa các phân tử. Vì vậy mà tinh thể phân tử dễ nóng chảy, dễ bay hơi.
* Bài 5 trang 71 SGK Hóa 10: Vì sao các hợp chất ion có nhiệt độ nóng chảy cao?
* Lời giải:
– Vì lực hút tĩnh điện giữa các ion ngược dấu trong tinh thể ion rất lớn. Các hợp chất ion đều khá rắn, khó bay hơn, khó nóng chảy.
* Bài 6 trang 71 SGK Hóa 10: Hãy nêu liên kết hóa học chủ yếu trong 3 loại mạng tinh thể đã biết.
* Lời giải:
Liên kết hóa học chủ yếu trong 3 loại mạng tinh thể đã biết:
– Trong mạng tinh thể nguyên tử: liên kết cộng hóa trị.
– Trong mạng tinh thể phân tử: lực tương tác yếu giữa các phân tử.
– Trong mạng tinh thể ion: lực hút tĩnh điện giữa các ion trái dấu.
Hy vọng với bài viết đã giúp các em hiểu được Tinh thể nguyên tử là gì? tinh thể phân tử là gì? cách giải các bài tập liên quan kiến thức này. Mọi góp ý và thắc mắc các em hãy để lại bình luận dưới bài viết, chúc các em học tốt.
Xem thêm Hóa 10 bài 14
Hóa 10 bài 14: Tinh thể nguyên tử là gì? tinh thể phân tử là gì? cho ví dụ và bài tập về tinh thể nguyên tử. Tại sao nước lỏng thì linh động và nặng, còn nước đá thì cứng và nhẹ hơn nước lỏng. Điều này là do trong tinh thể phân tử nước đá các phân tử nước sắp xếp theo một trật tự nhất định và ở cách xa nhau hơn trong nước lỏng. Bài này chúng ta sẽ tìm hiểu về tinh thể nguyên tử là gì? tinh thể phân tử là gì? cấu tạo và tính chất của tinh thể nguyên tử và tinh thể phân tử ra sao? I. Tinh thể nguyên tử 1. Tinh thể nguyên tử là gì? – Tinh thể nguyên tử cấu tạo từ những nguyên tử được sắp xếp một cách đều đặn, theo một trật tự nhất định trong không gian tạo thành mạng tinh thể. – Ở các nút của mạng tinh thể là những nguyên tử liên kết với nhau bằng các liên kết cộng hóa trị. * Ví dụ: Tinh thể kim cương: Mỗi nguyên tử cacbon liên kết với 4 nguyên tử cacbon khác bằng 4 liên kết cộng hóa trị. Mô hình cấu trúc tinh thể kim cương a) Sự sắp xếp tứ diện của bốn nguyên tử C xung quanh nguyên tử C trung tâm ở kim cương b) Tinh thể kim cương 2. Tính chất chung của tinh thể nguyên tử – Lực liên kết cộng hóa trị trong tinh thể nguyên tử rất lớn, vì vậy, tinh thể bền vững, rất cứng, nhiệt độ nóng chảy và nhiệt độ sôi khá cao. – Kim cương có độ cứng lớn nhất so với các tinh thể đã biết nên được quy ước có độ cứng là 10 đơn vị để đo độ cứng các chất khác. II. Tinh thể phân tử 1. Tinh thể phân tử là gì? – Tinh thể phân tử cấu tạo từ những phân tử được sắp xếp một cách đều đặn theo trật tự nhất định trong không gian tạo thành mạng tinh thể phân tử. – Ở các điểm nút của mạng tinh thể là những phân tử liên kết với nhau bằng lực tương tác yếu giữa các phân tử. – Phần lớn các chất hữu cơ, các đơn chất phi kim ở nhiệt độ thấp đều kết tinh thành mạng tinh thể phân tử (phân tử có thể gồm một nguyên tử như các khí hiếm, hoặc nhiều nguyên tử như: halogen, O2, N2, H2, H2O, H2S, CO2,…) * Ví dụ: Tinh thể phân tử I2 2. Tính chất tinh thể phân tử – Lực tương tác giữa các phân tử rất yếu nên các chất có cấu tạo tinh thể phân tử thường mềm, có nhiệt độ nóng chảy thấp, dễ bay hơi. – Các tinh thể không phân cực, dễ dàng hòa tan trong các dung môi không phân cực như: Benzen. toluen,… III. Bài tập về tinh thể nguyên tử, tinh thể phân tử * Bài 1 trang 70 SGK Hóa 10: Tìm câu sai trong các câu sau: A. Kim cương là một dạng thù hình của cacbon, thuộc loại tinh thể nguyên tử. B. Trong mạng tinh thể nguyên tử, các nguyên tử được phân bố luân phiên đều đặn theo một trật tự nhất định. C. Lực liên kết giữa các nguyên tử trong tinh thể nguyên tử là liên kết yếu. D. Tinh thể nguyên tử bền vững, rất cứng, nhiệt độ nóng chảy và nhiệt độ sôi cao. * Lời giải: – Câu sai: C. Lực liên kết giữa các nguyên tử trong tinh thể nguyên tử là liên kết yếu. Lực liên kết cộng hóa trị trong tinh thể nguyên tử rất lớn. * Bài 2 trang 70 SGK Hóa 10: Tìm câu sai trong các câu sau đây: A. Nước đá thuộc loại tinh thể phân tử. B. Trong tinh thể phân tử, lực liên kết yếu giữa các phân tử là liên kết cộng hóa trị. C. Trong tinh thể phân tử, lực liên kết giữa các phân tử là liên kết yếu. D. Tinh thể iot là tinh thể phân tử. * Lời giải: – Câu sai: B. Trong tinh thể phân tử, lực liên kết yếu giữa các phân tử là liên kết cộng hóa trị. Trong tinh thể phân tử, các phân tử hút nhau bằng lực tương tác yếu giữa các phân tử. * Bài 3 trang 71 SGK Hóa 10: Hãy kể tên các loại tinh thể đã học và tính chất chung của từng loại. * Lời giải: Các loại tinh thể đã học: – Tinh thể nguyên tử: tính chất chung: bền vững, rất cứng, nhiệt độ nóng chảy và nhiệt độ sôi khá cao. – Tinh thể phân tử: tính chất chung: dễ nóng chảy, dễ bay hơi. – Tinh thể ion: tính chất chung: rất bền vững, các hợp chất ion đề khá rắn, khó bay hơi, khó nóng chảy. * Bài 4 trang 71 SGK Hóa 10: a) Hãy đưa ra một số thí dụ chất có mạng tinh thể nguyên tử, chất có mạng tinh thể phân tử. b) So sánh nhiệt độ nóng chảy của hai loại tinh thể nói trên. Giải thích? * Lời giải: a) – Chất có mạng tinh thể nguyên tử: kim cương. – Chất có mạng tinh thể phân tử: ở nhiệt độ thấp thì có khí hiếm, O2, N2,… kết tinh thành tinh thể phân tử. b) Lực liên kết cộng hóa trị trong tinh thể nguyên tử rất lớn. Vì vậy, tinh thể nguyên tử đều bền vững, khá cứng, khó nóng chảy, khó bay hơi. Trong tinh thể phân tử, các phân tử hút nhau bằng lực tương tác yếu giữa các phân tử. Vì vậy mà tinh thể phân tử dễ nóng chảy, dễ bay hơi. * Bài 5 trang 71 SGK Hóa 10: Vì sao các hợp chất ion có nhiệt độ nóng chảy cao? * Lời giải: – Vì lực hút tĩnh điện giữa các ion ngược dấu trong tinh thể ion rất lớn. Các hợp chất ion đều khá rắn, khó bay hơn, khó nóng chảy. * Bài 6 trang 71 SGK Hóa 10: Hãy nêu liên kết hóa học chủ yếu trong 3 loại mạng tinh thể đã biết. * Lời giải: Liên kết hóa học chủ yếu trong 3 loại mạng tinh thể đã biết: – Trong mạng tinh thể nguyên tử: liên kết cộng hóa trị. – Trong mạng tinh thể phân tử: lực tương tác yếu giữa các phân tử. – Trong mạng tinh thể ion: lực hút tĩnh điện giữa các ion trái dấu. Hy vọng với bài viết đã giúp các em hiểu được Tinh thể nguyên tử là gì? tinh thể phân tử là gì? cách giải các bài tập liên quan kiến thức này. Mọi góp ý và thắc mắc các em hãy để lại bình luận dưới bài viết, chúc các em học tốt. Đăng bởi: Trường TCSP Mẫu giáo – Nhà trẻ Hà Nội Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc trường Trường THPT Phạm Hồng Thái. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường THPT Phạm Hồng Thái (thpt-phamhongthai.edu.vn)





