Hóa 9 bài 28: Tính chất hóa học của Cacbon Oxit (CO) Cacbon Đioxit (CO2) Ứng dụng và Bài tập vận dụng. Cacbon Oxit CO được ứng dụng làm nhiên liệu chất khử và nguyên liệu trong công nghiệp hóa học, còn Cacbon Đioxit CO2 được sử dụng để chữa cháy, bảo quản thực phẩm,…
Vậy Cacbon Oxit (CO) và Cacbon Đioxit (CO2) có tính chất hóa học và tính chất vật lý như thế nào, chúng có gì giống nhau và khác nhau về thành phần phân tử, được ứng dụng trong các lĩnh vực nào? chúng ta cùng tìm hiểu qua bài viết dưới đây.
I. Cacbon Oxit (CO)
– Công thức phân tử: CO
– Phân tử khối: 28
1. Tính chất vật lý của CO
– CO là chất khí không màu, không mùi, ít tan trong nước và rất độc.
2. Tính chất hóa học của CO
a) CO là oxit trung tính
– Ở điều kiện thường, CO không phản ứng với nước, kiềm và axit.
b) CO là chất khử
– Ở nhiệt độ cao, CO khử được điều oxit kim loại
• CO khử CuO (CO khử oxit đồng)
CO(k) + CuO(r,đen) 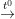 Cu(r,đỏ) + CO2(k)
Cu(r,đỏ) + CO2(k)
• CO khử Fe3O4 (CO khử oxit sắt trong lò cao)
4CO(k) + Fe3O4(r) 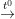 3Fe(r) + 4CO2(k)
3Fe(r) + 4CO2(k)
• CO cháy trong không khí (cháy trong oxi) với ngọn lửa màu xanh nhiều nhiệt
2CO(k) + O2(k) 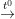 2CO2(k)
2CO2(k)
3. Ứng dụng của CO
– Cabonoxit CO có nhiều ưng dụng trong công nghiệp như: Dùng làm nhiên liệu, nguyên liệu, chất khử,…
II. Cacbon đioxit (CO2)
– Công thức phân tử: CO2
– Phân tử khối: 44
1. Tính chất vật lý của CO2
– CO2 là khí không màu, không mùi, không duy trì sự sống và sự cháy.
2. Tính chất hóa học của CO2
– CO2 có những tính chất hóa học của oxit axit.
a) CO2 tác dụng với nước
– CO2 tác dụng với nước tạo thành axit yếu dễ phân hủy
CO2(k) + H2O(l) 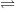 H2CO3(dd)
H2CO3(dd)
b) CO2 tác dụng với dung dịch bazơ
– CO2 tác dụng với dung dịch bazơ tạo thành muối và nước
• CO2(k) + 2NaOH(dd) → Na2CO3(dd) + H2O(l)
1 mol 2 mol
• CO2(k) + NaOH(dd) → NaHCO3(dd)
1 mol 1 mol
– Tùy vào tỉ lệ mol giữa CO2 và NaOH mà có thể tạo ra muối trung hòa, muối axit hay hỗn hợp 2 muối, nếu:
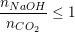 : Tạo thành muối NaHCO3
: Tạo thành muối NaHCO3
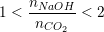 : Tạo 2 muối NaHCO3 và Na2CO3
: Tạo 2 muối NaHCO3 và Na2CO3
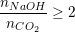 : Tạo muối Na2CO3
: Tạo muối Na2CO3
c) CO2 tác dụng với axit bazơ
CO2 + CaO → CaCO3
3. Ứng dụng của CO2
– CO2 được dùng để chữa cháy, bảo quản thực phẩm, sản xuất nước giải khát.
III. Bài tập về CO và CO2
* Bài 1 trang 87 SGK Hóa 9: Hãy viết phương trình hóa học của CO với: a) Khí O2; b) CuO.
Cho biết: loại phản ứng, điều kiện phản ứng, vai trò của CO và ứng dụng của mỗi phản ứng đó.
° Lời giải bài 1 trang 87 SGK Hóa 9:
a) phản ứng của CO với O2
2CO + O2 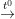 2CO2 (1)
2CO2 (1)
– Phản ứng hóa hợp + oxi hóa khử.
b) Phản ứng của CO với CuO
CO + CuO 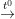 Cu + CO2 (2)
Cu + CO2 (2)
– Phản ứng oxi hóa khử
– Điều kiện phản ứng: nhiệt độ cao.
– Vai trò của CO: là chất khử.
– Ứng dụng: Phản ứng (1) CO cháy và tỏa nhiều nhiệt dùng trong các lò luyện gang, thép.
Phản ứng (2) ở điều kiện nhiệt độ cao khử oxit đồng CuO tạo kim loại Cu (điều chế Cu).
* Bài 2 trang 87 SGK Hóa 9: Hãy viết phương trình hóa học của CO2 với dung dịch NaOH, dung dịch Ca(OH)2 trong trường hợp:
a) Tỉ lệ số mol nCO2 : nNaOH = 1 : 1
b) Tỉ lệ số mol nCO2 : nCa(OH)2 = 2 : 1
° Lời giải bài 2 trang 87 SGK Hóa 9:
– Phương trình hóa học của CO2 với:
a) Dung dịch NaOH theo tỉ lệ số mol nCO2 : nNaOH = 1 : 1
CO2 + NaOH → NaHCO3
b) Dung dịch Ca(OH)2 theo tỉ lệ nCO2 : nCa(OH)2 = 2 : 1
2CO2 + Ca(OH)2 → Ca(HCO3)2↓
* Bài 3 trang 87 SGK Hóa 9: Có hỗn hợp hai khí CO và CO2. Nêu phương pháp hóa học để chứng minh sự có mặt của hai khí đó. Viết các phương trình hóa học.
° Lời giải bài 3 trang 87 SGK Hóa 9:
– Cho hỗn hợp khí lội qua bình chứa dung dịch nước vôi trong, nếu nước vôi trong vẩn đục, chứng tỏ trong hỗn hợp khí có khí CO2.
CO2 + Ca(OH)2 → CaCO3↓ + H2O
– Khí đi ra khỏi bình nước vôi trong được dẫn qua ống thủy tinh đựng CuO nung nóng, nếu thấy có kim loại màu đỏ sinh ra và khí sinh ra khỏi ống thủy tinh làm vẩn đục nước vôi trong thì chứng tỏ trong hỗn hợp đó có khí CO.
CO + CuO → Cu + CO2
* Bài 4 trang 87 SGK Hóa 9: Trên bề mặt hồ nước tôi vôi lâu ngày thường có lớp màng chất rắn. Hãy giải thích hiện tượng này và viết phương trình hóa học.
° Lời giải bài 4 trang 87 SGK Hóa 9:
– Do Ca(OH)2 tác dụng với khí CO2 trong không khí tạo nên lớp CaCO3 rất mỏng trên bề mặt nước vôi.
Ca(OH)2 + CO2 → CaCO3↓ + H2O.
* Bài 5 trang 87 SGK Hóa 9: Hãy xác định thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp CO và CO2, biết các số liệu thực nghiệm sau:
– Dẫn 16 lít hỗn hợp CO và CO2 qua nước vôi trong dư thu được khí A.
– Để đốt cháy A cần 2 lít khí oxi. Các thể tích khí đo được ở cùng điều kiện nhiệt độ và áp suất.
° Lời giải bài 5 trang 87 SGK Hóa 9:
– Khi dẫn hỗn hợp khí CO và CO2 qua nước vôi trong dư thu được khí A là khí CO, trong cùng điều kiện về nhiệt độ, áp suất thì tỉ lệ thể tích cũng bằng tỉ lệ về số mol.
– Phương trình phản ứng đốt cháy khí A:
2CO + O2 → 2CO2.
– Từ phương trình trên ta có: nCO = 2.nO2; vì tỉ lệ mol cũng là tỉ lệ thể tích, và theo bài ra số lít oxi lần dùng là VO2 = 2 lít, nên:
⇒ VCO = 2.VO2 = 2.2 = 4 lít.
– Theo bài ra, hỗn hợp gồm 16 lít CO và CO2 nên: VCO2 = 16 – 4 = 12 lít.
⇒ %VCO2 = 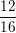 .100% = 75%;
.100% = 75%;
⇒ %VCO = 100% – 75% = 25%.
Hy vọng với bài viết về Tính chất hóa học của Cacbon Oxit (CO) Cacbon Đioxit (CO2) Ứng dụng và Bài tập giúp ích cho các em. Mọi thắc mắc và góp ý các em vui lòng để lại bình luận dưới bài viết để Trường TCSP Mẫu giáo – Nhà trẻ Hà Nội ghi nhận và hỗ trợ, chúc các em học tập tốt.
Bản quyền bài viết thuộc trường Trường THPT Phạm Hồng Thái. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường THPT Phạm Hồng Thái (thpt-phamhongthai.edu.vn)





