Các dạng bài tập Amino Axit có đáp án và lời giải. Bài tập về Amino Axit cũng có dạng gần tương tự bài tập về Amin. Ngoài dạng bài tập trắc nghiệm về nội dung lí thuyết còn có các bài tập tính toán dựa vào các phương trình phản ứng hóa học.
Dưới đây là các dạng bài tập của Amino Axit cơ bản có lời giải và đáp án dựa trên tính chất hóa học, đó là: Amino axit trong phản ứng với axit hoặc bazơ; Phản ứng đốt cháy của Amino Axit để các em tham khảo.
° Dạng 1: Bài tập liên quan phản ứng của Amino Axit với Axit và Bazơ
(Amino Axit lưỡng tính)
* Kiến thức vận dụng
• Amino axit có chứa cả -COOH mang tính axit và –NH2 mang tính bazo nên amino axit có tính lưỡng tính
• Nếu amino axit tác dụng với axit thì:
mMuối = mAmino axit + mAxit
• Nếu amino axit tác dụng với dung dịch kiềm thì:
mMuối = mAmino axit + mDd kiềm – mH2O
* Bài tập 1: Amino axit X có dạng H2NRCOOH (R là gốc hiđrocacbon). Cho 0,1 mol X phản ứng hết với dung dịch HCl (dư) thu được dung dịch chứa 11,15 gam muối. Xác định công thức tên gọi của X?
* Lời giải:
– Đề cho: nx = 0,1(mol); mMuối = 11,15(g);
– Bản chất của Amino axit phản ứng với axit là do gốc amin, nên có:
–NH2 + H+ → NH3+ (1)
– Theo bài ra và theo PTPƯ ta có:
nHCl = nX = 0,1(mol) ⇒ mHCl = 0,1.36,5 = 3,65(g).
– Mặt khác, mMuối = mx + mHCl ⇒ mX = mMuối – mHCl = 11,15 – 3,65 = 7,5(g)
⇒ Khối lượng mol phân tử X (H2NRCOOH) là:
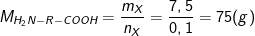
⇒ 16 +R + 45 = 75 ⇒ R = 14 ≡ (-CH2-)
→ Vậy công thức của X là H2NCH2COOH. Tên gọi của X là glyxin.
* Bài tập 2: Hỗn hợp X gồm alanin và axit glutamic. Cho m gam X tác dụng hoàn toàn với dung dịch NaOH (dư), thu được dung dịch Y chứa (m + 30,8) gam muối. Mặt khác, nếu cho m gam X tác dụng hoàn toàn với dung dịch HCl, thu được dung dịch Z chứa (m + 36,5) gam muối. Tính m?
* Lời giải:
– Đề cho hỗn hợp X gồm alanin: H2N – CH(CH3) – COOH
và glutamic: HOOC – (CH2)2 – CH(NH2) – COOH.
– Gọi x, y lần lượt là số mol của alanin và glutamic
– PTPƯ của analin và glutamic với NaOH và HCl như sau:
-COOH + NaOH → -COONa + H2O (1)
(x+2y) mol (x+2y) mol
-NH2 + HCl → NH3Cl (2)
(x+y)mol (x+y) (x+y) mol
– Từ PTPƯ (1) và (2) ta có hệ:
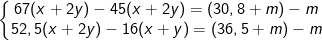
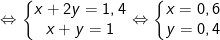
⇒ m = 0,6.89 + 0,4.147 = 112,2 gam.
* Bài tập 3: Cho hỗn hợp 2 aminoaxit no chứa 1 chức axit và 1 chức amino tác dụng với 110 ml dung dịch HCl 2M được dung dịch X. Để tác dụng hết với các chất trong X, cần dùng 140 ml dung dịch KOH 3M. Tính tổng số mol 2 aminoaxit?
* Lời giải:
– Đề cho: Vdd HCl = 110(ml) = 0,11(l); CM(HCl) = 2M
⇒ nHCl = V.CM = 0,11.2 = 0,22(mol)
Vdd KOH = 140(ml) = 0,14(l); CM(KOH) = 3M
⇒ nKOH = V.CM = 0,14.3 = 0,42(mol)
– Hai Aminoaxit trên có dạng NH2-R-COOH
– Ta có sơ đồ quá trình phản ứng như sau:
![NH_2-R-COOHxrightarrow[]{+HCl}left{begin{matrix} NH_3-R-COOH HCl end{matrix}right. 1600766921215lwnd1vv 1600821483 1600766921215lwnd1vv 1600821483](https://thpt-phamhongthai.edu.vn/wp-content/uploads/2022/11/1600766921215lwnd1vv_1600821483.gif)
![xrightarrow[]{+KOH}left{begin{matrix} KCl NH_2-R-COOK end{matrix}right. 16007669259owza25i5w 1600821484 16007669259owza25i5w 1600821484](https://thpt-phamhongthai.edu.vn/wp-content/uploads/2022/11/16007669259owza25i5w_1600821484.gif)
– Áp dụng định luật bảo toàn nguyên tố Cl
⇒ nHCl = nKCl = 0,22 (mol)
– Áp dụng định luật bảo toàn nguyên tố K
⇒ nKOH = nKCl + nNH2-R-COOK
⇒ nNH2-R-COOK = 0,42 – 0,22 = 0,2(mol)
⇒ nAmino axit = nNH2-R-COOK = 0,2(mol)
* Bài tập 4: Hợp chất X là một a-amino axit. Cho 0,01 mol X tác dụng vừa đủ với 80 ml dung dịch HCl 0,125M, sau đó đem cô cạn dung dịch thu được 1,835 gam muối. Phân tử khối của X là bao nhiêu?
* Lời giải:
– Đề cho: Vdd HCl = 80(ml) = 0,08(l); CM HCl = 0,125M
⇒ nHCl = V.CM = 0,08.0,125 = 0,01(mol)
mMuối = 1,835(g); nX = 0,01 (mol).
– Áp dụng định luật bảo toàn khối lượng ta có:
mX + mHCl = mMuối
⇒ mX = 1,835 – 0,01.36,5 = 1,47 (gam)
– Khối lượng mol của X là: 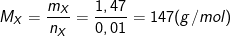
° Dạng 2: Phản ứng đốt cháy của Amino axit
* Kiến thức vận dụng:
* Bài tập 1: Đốt cháy hoàn toàn 17,4 gam một amino axit có 1 nhóm –COOH được 0,6 mol CO2, 0,5 mol H2O và 0,1 mol N2. Tìm công thức phân tử của amino axit?
* Lời giải:
– Ta có X có dạng CxHyO2Nz
2CxHyO2Nz → 2xCO2 + yH2O + zN2
nC = nCO2 = 0,6 (mol).
nH = 2.nH2O = 2.0,5 = 1 (mol).
nN = 2.nN2 = 2.0,1 = 0,2 (mol).
mO = mX – mC – mH – mN = 17,4 – 0,6.12 – 1.1 – 0,2.14 = 6,4 (g).
nO = 0,4 (mol).
– Ta có x : y : 2 : z = nC : nH : nO : nN = 0,6 : 1 : 0,4 : 0,2 = 3 : 5 : 2 : 1
→ Vậy X là C3H5O2N
* Bài tập 2: Khi đốt cháy hoàn toàn một amino axit X là đồng đẳng của axit aminoaxetic, thu được . Viết công thức cấu tạo thu gọn có thể có của X là :
* Lời giải:
– X là đồng đẳng của axit amino axetic
⇒ X là amino axit no, đơn chức mạch hở
– CTPT của X có dạng: CnH2n+1NO2
– Ta có phương trình phản ứng cháy của aminoaxit:
CnH2n+1NO2 + [(6n-3)/4]O2 → nCO2 + [(2n+1)/2]H2O + (1/2)N2
– Vì tỉ lệ về thể tích cũng chính là tỉ lệ về số mol nên:
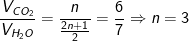
⇒ CTPT của X là: C3H7NO2
⇒ CTCT của X có thể có là: CH3CH(NH2)COOH, H2NCH2CH2COOH.
* Bài tập 3: Đốt cháy 8,7 gam amino axit X thì thu được 0,3 mol CO2 ; 0,25 mol H2O và 0,05 mol N2 (đktc). Xác định CTPT của X?
* Lời giải:
– Áp dụng định luật bảo toàn nguyên tố ta có:
nC = nCO2 = 0,3 (mol).
nH = 2nH2O = 0,25 .2 = 0,5 (mol).
nN = 2nN2 = 0,05 .2 = 0,1 (mol).
mO = mX – mC – mH – mO
⇒ mO = 8,7 – 0,3 .12 – 0,5 . 1 – 0,1 . 14 = 3,2 (g)
⇒ nO = 3,2/16 = 0,2 (mol)
Ta có: nC : nH : nN : nO = 0,3 : 0,5 : 0,1 : 0,2 = 3 : 5 : 1 : 2
⇒ CTPT của X là : C3H5NO2
Như vậy, chúng ta đã biết 2 dạng toán vận dụng tính lưỡng tính của Amino Axit (vừa tác dụng được với axit, vừa tác dụng được với bazơ) và phản ứng cháy của Amino axit. Đây là nội dung cũng hay xuất hiện trong nội dung đề thi tốt nghiệp THPT, vì vậy, các em hãy cố gắng ghi nhớ kỹ.
Bản quyền bài viết thuộc trường Trường THPT Phạm Hồng Thái. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường THPT Phạm Hồng Thái (thpt-phamhongthai.edu.vn)





